Abstract
Pre-eclampsia is a medical complication in pregnancy that occurs in about 5% of pregnant women, after the 20th week of gestation. This complication causes serious health effects on pregnant women, even death in both those women and their fetuses. Pre-eclampsia patients are characterized by gestational hypertension associated with proteinuria and histological evidence of glomerular injury. Many reports suggested certain biomarkers of pre-eclampsia, including a decreased VEGF (Vascular Epithelial Growth Factor) level or an increased sFlt-1 (VEGF receptor) level in serum, which is related to an increase in the risk of this issue. Pre-eclampsia might be associated with an increased risk of several kidney diseases for many years following diagnosis with this issue. Evidence showed that women with a history of pre-eclampsia might have a higher risk of kidney diseases such as end-stage renal disease (ESRD) and focal segmental glomerulosclerosis (FSGS) than women with healthy pregnancies. Other studies showed that podocytes might be involved in glomerular lesions in pre-eclampsia patients. Podocytes are specialized epithelial cells located on the surface of the glomerular capillary, which is part of the glomerular filter membrane along with the endothelial cells and the glomerular basement membrane. Podocytes have a responsibility to ensure the glomerular membrane’s selective permeability. Some methods recently are being developed to detect the podocytes in urine samples such as immunohistochemistry, Reverse Transcriptase Polymerase Chain Reaction (RT – PCR), suggesting the potential application of those cells as biomarkers in the early diagnosis of pre-eclampsia. This review summarized the evidence about the role of podocytes in the pathological mechanism of pre-eclampsia, the risk of chronic kidney diseases as well as the potential predictive value of podocytes in the early diagnosis of pre-eclampsia.
TỔNG QUAN VỀ TIỀN SẢN GIẬT
Tiền sản giật (TSG) là một biến chứng nội khoa trong thai kỳ thường xảy ra khoảng 5% thai phụ, sau tuần thai thứ 20, được đặc trưng bởi các triệu chứng như tăng huyết áp kết hợp với tình trạng tăng nồng độ đạm trong nước tiểu. Tỉ lệ TSG/sản giật có thể khác nhau tuỳ thuộc vào chủng tộc ( Figure 1 ) 1 . TSG có khả năng gây ra các tổn thương nặng đến sức khoẻ cả thai phụ và thai nhi, thậm chí có thể gây tử vong 2 . Sự phát triển của biến chứng TSG được cho là quá trình gồm hai giai đoạn chính. Giai đoạn đầu thường không có triệu chứng rõ rệt, có thể liên quan đến tình trạng thiếu máu cục bộ ở nhau thai. Giai đoạn sau, nhau thai có thể hình thành các yếu tố hoà tan vào hệ tuần hoàn của người mẹ, dẫn đến rối loạn chức năng của các tế bào nội mô và các triệu chứng lâm sàng khác, đặc biệt là các vấn đề liên quan đến bệnh lý ở thận và huyết áp. Dữ liệu nghiên cứu gần đây cho thấy một số chất có tính kháng lại nhân tố tăng trưởng nội mô mạch máu VEGF (Vascular Endothelial Growth Factor) có thể là một trong những tác nhân gây tổn thương diện rộng hệ thống mạch máu trên toàn cơ thể dẫn đến triệu chứng tăng huyết áp, cũng như các tác động của chất này gây ra tổn thương tại cầu thận 3 . Một nghiên cứu cũng cho thấy hiện tượng phù nề ở những thai phụ được chẩn đoán TSG cũng liên quan đến sự thiếu hụt nhân tố VEGF 4 . Tuy nhiên, nguyên lý bệnh sinh gây ra TSG hiện nay vẫn chưa rõ, do đó trong quá trình theo dõi sức khoẻ thai kỳ, trong thực hành lâm sàng hiện nay vẫn chưa thể đưa ra các chiến lược dự phòng và điều trị cụ thể. Vài nghiên cứu gần đây chỉ ra rằng TSG có liên quan đến sự tăng biểu hiện các thụ thể liên kết với nhân tố VEGF, thường được gọi là thụ thể sFlt-1. Thụ thể này có thể gắn và trung hoà nhân tố VEGF, dẫn đến suy giảm nồng độ VEGF tự do dạng hoà tan 5 , 6 . Sự tăng biểu hiện của thụ thể sFlt-1 được chứng minh là có mối liên quan chặt chẽ với mức độ nghiêm trọng của TSG 3 , 7 cũng như với mức độ của tình trạng đạm niệu ở những thai phụ được chẩn đoán mắc TSG 8 .
Hội chứng HELLP (Hemolysis, Elevated Liver enzymes and Low Platelets) được mô tả như một dạng TSG nghiêm trọng xảy ra ở giai đoạn muộn của thai kỳ (tuần thai 32 – 34) hoặc sau sinh, với tỉ lệ mắc được báo cáo khoảng 0,17 – 0,85% tổng số ca có trẻ sinh sống 9 . Biểu hiện của hội chứng này thường là các rối loạn chức năng nội mô, kích hoạt sự đông máu nội mạch với sự lắng đọng fibrin bất thường. Theo các báo cáo, 20% các trường hợp mắc hội chứng HELLP không có triệu chứng tăng huyết áp và 5 – 15% có tình trạng đạm niệu thấp hoặc không có biểu hiện đạm niệu. Cho đến nay, vẫn chưa có các phương pháp chẩn đoán sớm tình trạng này 9 .
Figure 1 . Tỉ lệ thai phụ mắc TSG/sản giật theo chủng tộc, số liệu ghi nhận 2005 - 2014 1 .
TỔN THƯƠNG CẦU THẬN Ở THAI PHỤ ĐƯỢC CHẨN ĐOÁN MẮC TIỀN SẢN GIẬT
Các bằng chứng về tổn thương cầu thận ở thai phụ mắc tiền sản giật
Nhiều nghiên cứu đã ghi nhận sự thiếu chính xác của các chẩn đoán lâm sàng đơn thuần về mối tương quan giữa bệnh lý do tổn thương cầu thận và TSG. Một nghiên cứu thống kê được thực hiện trên các thai phụ chẩn đoán mắc TSG với tuổi thai dưới 37 tuần. Các thai phụ này được thực hiện sinh thiết mô cầu thận cho thấy chỉ có 67% các trường hợp mắc các bệnh lý trên thận không liên quan đến TSG. Cho đến nay, các xét nghiệm sinh thiết mô học trên mô cầu thận vẫn là các xét nghiệm cung cấp các bằng chứng tin cậy nhất trong chẩn đoán chính xác TSG, nhằm loại trừ các chẩn đoán nhầm do bệnh lý trên thận sẵn có ở các thai phụ này 10 . Theo báo cáo của Nochy và cộng sự, các phân tích mô học ở thai phụ mắc TSG cho thấy có dấu hiệu sưng tấy của các tế bào nội mô và tế bào trung bì trong cấu trúc cầu thận. Thể tích cầu thận cũng tăng lên tuỳ thuộc vào mức độ sưng tấy của các mô cầu thận và có mối tương quan thuận với mức độ nghiêm trọng của TSG. Báo cáo này cũng cho thấy các thay đổi cấu trúc nội mô cầu thận chỉ giới hạn ở các mao mạch cầu thận, trong khi các tiểu động mạch ở cơ quan này hầu như không bị ảnh hưởng 11 .
Các tổn thương ở cầu thận có thể gây ra tình trạng suy giảm chức năng lọc ở cơ quan này. Tốc độ lọc của cầu thận ở những thai phụ được chẩn đoán mắc TSG giảm đáng kể so với những thai phụ khoẻ mạnh. Các phân tích mô học ở những thai phụ này, ngoài dấu hiệu sưng tấy ở các tế bào nội mô, còn có sự kết tụ fibrin bất thường ở cấu trúc màng lọc của cầu thận, dẫn đến mặc dù thể tích cầu thận tăng lên nhưng diện tích bề mặt vùng chức năng lọc của cầu thận giảm đi đáng kể 12 . Cystatin C được cho là có vai trò quan trọng trong quá trình xâm lấn của các tế bào lá nuôi phôi vào lớp cơ tử cung trong quá trình làm tổ của phôi thai. Sự gia tăng mức độ biểu hiện của mRNA Cystatin C ở nhau thai được ghi nhận có khác biệt đáng kể ở những thai phụ được chẩn đoán mắc TSG so với những thai phụ khoẻ mạnh. Tuy nhiên, các bằng chứng vẫn chưa đủ sức thuyết phục để có thể sử dụng Cystatin C như một dấu ấn sinh học (biomarker) trong đánh giá tốc độ lọc của cầu thận ở những thai phụ mắc TSG 13 .
Nghiên cứu của Levine và cộng sự chỉ ra rằng nồng độ cao của sFlt-1 lưu hành trong máu ở thai phụ mắc TSG có liên quan đến sự toàn vẹn cũng như các hoạt động của các tế bào cầu thận có chân (podocyte) kể cả ở những phụ nữ không có triệu chứng tăng huyết áp, cho thấy TSG có thể diễn tiến âm thầm ở các giai đoạn sớm của thai kỳ 6 .
Nguy cơ phát triển các bệnh lý cầu thận ở những phụ nữ từng được chẩn đoán tiền sản giật
Cho đến nay, khá nhiều các bằng chứng cho thấy thai phụ được chẩn đoán TSG có thể làm tăng nguy cơ mắc các bệnh lý trên cầu thận sau này 14 . Báo cáo của Bar J. và cộng sự chỉ ra rằng các trường hợp thai phụ được chẩn đoán TSG có tỉ lệ mắc phải triệu chứng microalbumin niệu trong năm năm sau đó cao hơn so với những thai phụ có thai kỳ khoẻ mạnh 15 . Một nghiên cứu tại Na Uy công bố vào năm 2008 cho thấy tỉ lệ phụ nữ mắc bệnh thận mãn tính (end-stage renal disease – ESRD) cao hơn rõ rệt ở nhóm phụ nữ có tiền sử TSG 16 . Một nghiên cứu khác gần đây được thực hiện tại Thuỵ Điển trên nhóm phụ nữ được chẩn đoán TSG trong ít nhất 1 lần mang thai cho thấy nhóm phụ nữ này có nguy cơ phát triển bệnh thận mãn tính cao hơn gấp năm lần so với những phụ nữ không có tiền sử TSG. Nghiên cứu này cũng chứng minh rằng mối tương quan này không bị phụ thuộc vào bất kỳ yếu tố gây nhiễu nào trong suốt quá trình phân tích dữ liệu, có thể kể đến như tình trạng đồng mắc các bệnh lý khác, tình trạng kinh tế xã hội cũng như độ tuổi của những thai phụ tham gia nghiên cứu, khẳng định mối tương quan thực sự giữa TSG và nguy cơ tiến triển bệnh thận mãn tính 17 .
Bên cạnh bệnh thận mãn tính, TSG cũng được cho là yếu tố nguy cơ gây ra tình trạng xơ hoá cầu thận khu trú (Focal Segmental Glomerulosclerosis – FSGS). Mỗi cầu thận người trưởng thành có khoảng 500 – 600 tế bào cầu thận có chân. Các thử nghiệm trên mô hình chuột cho thấy các tổn thương cầu thận gây mất khoảng 20% số lượng các tế bào này ở cầu thận có thể gây ra tình trạng xơ hoá cầu thận khu trú 18 . Sự mất các tế bào cầu thận có chân có thể dẫn đến hình thành các cấu trúc xơ cứng thứ cấp ở khu vực cầu thận, do các tế bào biểu mô thành cầu thận (Perietal Epithelial Cells – PEC) biểu hiện các phân tử đánh dấu bề mặt là CD44 19 . Các phân tử đánh dấu bề mặt CD44 khiến cho các tế bào PEC liên kết chặt chẽ với nhau hơn, làm thay đổi cấu trúc mô cầu thận, hình thành các mảng xơ hoá. Nghiên cứu của Smeets chỉ tìm thấy các tế bào PEC có biểu hiện phân tử đánh dấu bề mặt CD44 ở các mảng xơ cứng trong cấu trúc cầu thận 20 . Một nghiên cứu tiến hành khảo sát trên bệnh nhân mắc bệnh lý xơ hoá cầu thận khu trú vô căn chỉ ra rằng tình trạng đạm niệu có thể kích thích quá trình chết theo chương trình theo con đường tín hiệu phụ thuộc Fas xảy ra mạnh mẽ hơn trên các tế bào biểu mô của ống lượn gần và ống lượn xa, gây ra các tổn thương lan rộng trong cấu trúc cầu thận 21 . Ngoài ra, các tổn thương trên tế bào cầu thận có chân có thể được truyền tín hiệu sang các tế bào cầu thận có chân lân cận, gây ra hiệu ứng domino. Điều này cũng góp phần lan rộng các tổn thương trên nhiều tế bào cầu thận có chân hơn ở bệnh nhân mắc bệnh lý xơ hoá cầu thận khu trú 22 . Báo cáo loạt ca của Lioufas (2016) chỉ ra rằng TSG có thể có liên quan với nguy cơ phát triển tình trạng xơ hoá cầu thận khu trú ở phụ nữ do gây ra các tổn thương trên tế bào cầu thận có chân, tuy nhiên, vẫn chưa đủ bằng chứng để làm rõ quan hệ nguyên nhân – kết quả giữa TSG và tình trạng bệnh lý này 23 .
VAI TRÒ CỦA CÁC TẾ BÀO CẦU THẬN CÓ CHÂN TRONG TỔN THƯƠNG CẦU THẬN Ở THAI PHỤ ĐƯỢC CHẨN ĐOÁN MẮC TIỀN SẢN GIẬT
Vai trò của các tế bào cầu thận có chân trong chức năng sinh lý của cầu thận
Tế bào cầu thận có chân là các tế bào biểu mô chuyên biệt nằm trên bề mặt búi mao mạch cầu thận, là một phần của màng lọc cầu thận cùng với các tế bào nội mô và màng đáy cầu thận (GBM – glomerular basement membrane), đảm bảo tính thấm chọn lọc của màng lọc cầu thận. Các tế bào cầu thận có chân đóng vai trò tích cực trong quá trình ngăn chặn các protein huyết tương xâm nhập vào dịch lọc xuất ra theo đường tiết niệu 24 . Ở cầu thận của người trưởng thành, các tế bào cầu thận có chân là loại tế bào duy nhất tham gia vào quá trình trao đổi chất ở màng đáy cầu thận, tổng hợp các thành phần liên quan đến hoạt động lọc của màng đáy, tham gia sản xuất các protease cần thiết 25 và sinh tổng hợp các protein có tác dụng điều hoà các đặc tính biểu hiện cũng như chức năng của tế bào nội mô cầu thận 26 . Các tế bào cầu thận có chân có thể tự thay đổi cấu trúc tế bào nhằm chống lại áp lực có thể gây phồng các mao mạch bên trong cầu thận, giúp ổn định cấu trúc cầu thận 27 ( Figure 2 ).
Figure 2 . Sự khác biệt trong cấu trúc và chức năng của các tế bào cầu thận có chân ở thai kỳ khoẻ mạnh và thai kỳ TSG 26 . Sự suy giảm chức năng tiết nhân tố VEGF ở các tế bào cầu thận có chân ở các trường hợp thai phụ mắc TSG làm thay đổi cấu trúc tế bào và khả năng liên kết giữa các tế bào cầu thận có chân trong cấu trúc cầu thận, dẫn đến bài tiết các tế bào này ra nước tiểu.
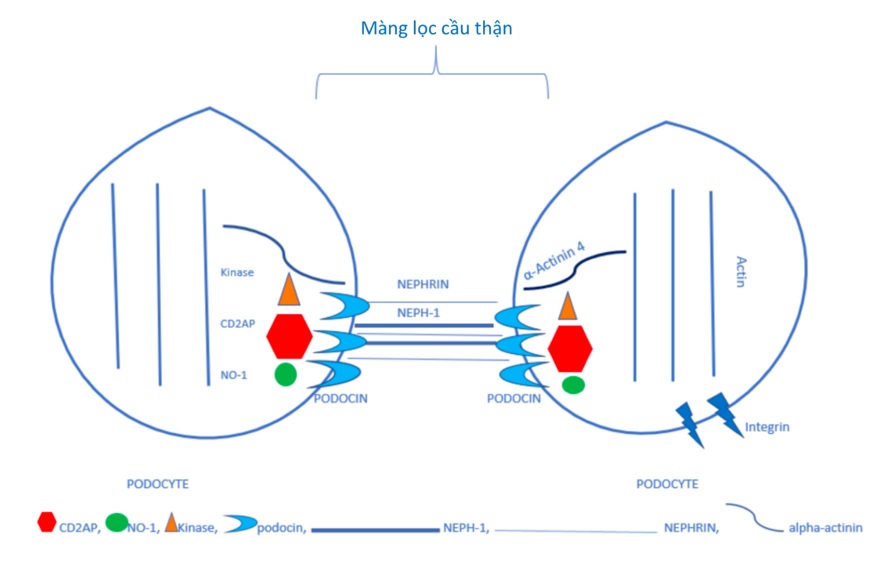
Các tế bào cầu thận có chân tiết ra một số protein đặc trưng, gồm nephrin, CD2AP, podocin, VEGF,… được cho là đóng vai trò quan trọng trong hoạt động của các tế bào này đối với chức năng của cầu thận. Protein nephrin gồm ba vùng cấu trúc chính: vùng ngoại bào, vùng xuyên màng và vùng nội bào. Vùng ngoại bào của protein này tạo thành mạng lưới liên kết, góp phần hình thành cấu trúc màng lọc cầu thận. Vùng nội bào của nephrin tương tác với protein khác như CD2AP, CD3, podocin và các protein kinase bên trong các tế bào cầu thận có chân, giúp truyền tín hiệu từ màng lọc cầu thận vào bên trong các tế bào này. Một protein tương tự nephrin, Neph1, cũng góp phần không nhỏ vào việc hình thành cấu trúc màng lọc cầu thận 28 . Các tương tác giữa nephrin – podocin – CD2AP được cho là thiết yếu cho sự hình thành dòng chảy của dịch lọc cũng như dòng chảy của các protein thông qua màng lọc cầu thận 29 ( Figure 3 ). Tuy nhiên, một nghiên cứu khác lại chỉ ra rằng nephrin, podocin, CD2AP và 𝛼-actinin trong các tế bào cầu thận có chân không thực sự có các tương tác chặt chẽ. Điều này cho thấy dường như các phân tử này có các cơ chế tương tác khá phức tạp trong hoạt động của các tế bào cầu thận có chân và các cơ chế này vẫn chưa được hiểu rõ 30 . Nhân tố kích thích sự sinh mạch VEGF được sản sinh ra bởi các tế bào cầu thận có chân có thể liên kết với heparan sulfate ở màng đáy cầu thận 31 , cần thiết cho kích thích phản ứng phosphoryl hoá nephrin xảy ra trong các tế bào này, từ đó ngăn chặn quá trình chết theo chương trình (apoptosis) của các tế bào cầu thận có chân và các tế bào nội mô cầu thận 32 . Các thử nghiệm sử dụng kháng thể kháng lại nhân tố VEGF hoặc sFlt-1 ngăn chặn quá trình biểu hiện của các nephrin trong các tế bào cầu thận có chân và khởi phát quá trình chết theo chương trình ở các tế bào này 33 . Vài báo cáo chỉ ra rằng các tế bào cầu thận có chân có thể được tiết ra nước tiểu trong giai đoạn cấp tính của một số bệnh lý cầu thận 34 . Những bệnh nhân này có thể bài tiết đến 388 tế bào cầu thận có chân/mg creatinine, trong khi mật độ tế bào này chỉ khoảng 0,5 tế bào/mg creatinine ở nhóm chứng khoẻ mạnh 35 . Sự khác biệt này được cho là các tế bào cầu thận có chân trong các bệnh lý cầu thận có thể bị tổn thương và tách ra khỏi cấu trúc cầu thận, trong khi ở những người khoẻ mạnh, các tế bào này chỉ tiết ra nước tiểu do lão hoá.
Figure 3 . Vai trò của các tế bào cầu thận có chân (podocyte) trong hình thành cấu trúc màng lọc cầu thận 36 . Các protein nephrin, Neph1, podocin và CD2AP có nguồn gốc từ các tế bào cầu thận có chân góp phần duy trì liên kết chặt chẽ giữa các tế bào này, hình thành cấu trúc màng lọc cầu thận.
Tương quan tổn thương trên các tế bào cầu thận có chân và tiền sản giật
Nhiều bằng chứng cho thấy có sự tương quan giữa hoạt động của các tế bào cầu thận có chân và TSG, chủ yếu là các hoạt động tiết các protein đặc trưng của loại tế bào này. Báo cáo của Garovic cho thấy tình trạng đạm niệu và sự gia tăng biểu hiện sFlt-1 ở những thai phụ được chẩn đoán TSG có mức độ trầm trọng tăng dần theo thời gian, điều này khẳng định thêm vai trò của sFlt-1 trong sự rối loạn hoạt động tiết ở các tế bào cầu thận có chân 37 . Báo cáo này cũng cho rằng sự sụt giảm biểu hiện các protein nephrin và VEGF ở tế bào cầu thận có chân có thể liên quan đến tình trạng đạm niệu ở các thai phụ mắc TSG. Ở các trường hợp TSG, nồng độ protein nephrin và podoxycalyxin trong nước tiểu tăng cao đáng kể so với các thai phụ khoẻ mạnh. 𝛽ig-h3 cũng được phát hiện trong mẫu nước tiểu ở các thai phụ TSG và được chứng minh là có tương quan với nồng độ nephrin và podocalyxin trong nước tiểu. Các kết quả này cung cấp các bằng chứng về sự rò rỉ các protein đặc trưng của các tế bào cầu thận có chân vào nước tiểu, làm tăng tình trạng đạm niệu và sự hiện diện của nhân tố tăng trưởng 𝛽ig-h3 cho thấy thực sự tồn tại các tổn thương cầu thận diễn tiến trong các trường hợp TSG 38 . Ngoài ra, số lượng tế bào cầu thận có chân tiết ra nước tiểu và nồng độ VEGF có tương quan với tỉ lệ albumin/creatinine niệu. Nghiên cứu của Chen và cộng sự cũng chỉ ra rằng các rối loạn trong hoạt động điều hoà các nhân tố tạo mạch như VEGF và tình trạng tổn thương các tế bào cầu thận có chân có thể đóng vai trò quan trọng trong cơ chế tiến triển của tình trạng đạm niệu trong biến chứng TSG 39 .
Các tế bào cầu thận có chân nuôi cấy in vitro được kích thích bởi huyết thanh thu nhận từ các thai phụ mắc TSG xảy ra các khác biệt trong quá trình biểu hiện các protein CD2AP, podocin và actin so với các tế bào được kích thích bởi huyết thanh của những thai phụ thuộc nhóm chứng. Sự thay đổi trong biểu hiện cũng như sự phân bố của podocin, CD2AP được cho là có thể gây ra các rối loạn trong hoạt động của phức hợp nephrin – Neph1- podocin ở màng lọc cầu thận 40 . Một nghiên cứu khác cho thấy các tế bào cầu thận có chân nuôi cấy in vitro không bị thay đổi biểu hiện nếu chỉ kích thích bởi huyết thanh thu nhận từ các thai phụ TSG 41 . Tuy nhiên, các quan sát trong nghiên cứu ghi nhận những thay đổi biểu hiện nephrin ở các tế bào cầu thận có chân nuôi cấy in vitro xảy ra khi kết hợp kích thích các tế bào này bằng huyết thanh được ủ với dịch nội mô cầu thận thu nhận từ các thai phụ TSG. Bên cạnh đó, nghiên cứu này còn thử nghiệm sử dụng chất đối vận của thụ thể endothelin-1 để chứng minh sự giảm biểu hiện nephrin chịu ảnh hưởng trực tiếp bởi hoạt động của thụ thể endothelin-1 do tăng tính thấm ở cầu thận. Nghiên cứu của Zhao S phát hiện nephrin và GLEPP-1 chủ yếu được biểu hiện ở các tế bào cầu thận, trong khi ezrin được biểu hiện ở các tế bào cầu thận có chân, tế bào vỏ và biểu mô ống thận. Nephrin, ezrin và GLEPP-1 giảm đáng kể ở thai phụ mắc TSG. Tuy nhiên, các bằng chứng từ nghiên cứu này vẫn chưa thể khẳng định được các tổn thương tế bào cầu thận có chân là nguyên nhân hay là hậu quả của TSG 42 . Tuy nhiên, các liệu pháp bổ sung nhân tố VEGF ngoại sinh được chứng minh là có khả năng hỗ trợ khôi phục sự toàn vẹn cũng như chức năng của các tế bào cầu thận có chân trong cấu trúc cầu thận ở thai phụ mắc TSG 43 .
Ngoài các bằng chứng trong rối loạn sinh tổng hợp protein và tình trạng tổn thương do khởi phát sự chết theo chương trình ở các tế bào cầu thận có chân, vài báo cáo đã tìm ra mối tương quan giữa sự thay đổi biểu hiện của các micro RNA (miRNA) và biến chứng TSG. miRNA là các phân tử RNA không mã hoá protein, có kích thước nhỏ khoảng 22 ribonucleotide, tham gia điều hoà hoạt động biểu hiện gene trong tế bào 44 . Vài báo cáo ghi nhận bằng chứng về sự thiếu hụt hoặc loại bỏ hoàn toàn enzyme Dicer – đóng vai trò quan trọng trong quá trình sản sinh các phân tử miRNA, có thể gây ra sự thay đổi hình dạng các tế bào cầu thận có chân 45 và từ đó làm giảm chức năng màng lọc cầu thận tạo bởi các tế bào này, gây ra tình trạng đạm niệu ở thai phụ mắc TSG 46 .
TẾ BÀO CẦU THẬN CÓ CHÂN – DẤU ẤN SINH HỌC TRONG CHẨN ĐOÁN SỚM NGUY CƠ TIỀN SẢN GIẬT
Với nhiều bằng chứng về vai trò quan trọng của các tế bào cầu thận có chân cũng như khả năng phát hiện sự hiện diện của các tế bào này và sản phẩm sinh học của chúng trong nước tiểu, các tế bào cầu thận có chân có thể được quan tâm trong các nghiên cứu nhằm phát triển các xét nghiệm sử dụng tế bào này như một dấu ấn sinh học chẩn đoán sớm nguy cơ TSG.
Nghiên cứu của Garovic thực hiện trên nhóm gồm 44 thai phụ được chẩn đoán TSG so sánh với nhóm chứng gồm 23 thai phụ khoẻ mạnh có huyết áp bình thường. Kết quả nghiên cứu ghi nhận 15/44 thai phụ TSG và 16/23 thai phụ thuộc nhóm chứng ghi nhận tình trạng đạm niệu và thành phần các protein này đều là các protein đặc trưng cho các tế bào cầu thận có chân. Tuy nhiên, chỉ có những thai phụ mắc TSG được ghi nhận bằng chứng về sự hiện diện của các tế bào có chân trong nước tiểu. Nghiên cứu này chỉ ra rằng việc định lượng các tế bào cầu thận có chân trong nước tiểu có giá trị tiên lượng TSG cao hơn đáng kể so với việc định lượng đơn thuần tình trạng đạm niệu hoặc định lượng nồng độ VEGF trong huyết thanh 47 . Báo cáo của Aita cũng cung cấp các bằng chứng cho thấy tình trạng đạm niệu không có ý nghĩa tiên lượng nếu áp dụng trên từng trường hợp TSG cụ thể. Hơn nữa, các phân tích của báo cáo này chỉ ra rằng số lượng tế bào cầu thận có chân bài tiết qua nước tiểu kết hợp với tình trạng tăng huyết áp và tình trạng đạm niệu có ý nghĩa tiên lượng cao hơn sử dụng đơn lẻ các yếu tố. Nghiên cứu này cũng cho rằng sự mất các tế bào cầu thận có chân tại cầu thận là nguyên nhân gây ra tình trạng tiết các tế bào này qua nước tiểu cũng như gây ra tình trạng đạm niệu ở thai phụ mắc TSG 48 .
Huyết áp tăng cao cũng được cho là yếu tố tác động gây ra tình trạng mất các tế bào cầu thận có chân và gây tiết các tế bào này qua nước tiểu 49 . Nghiên cứu của Zhao S cho thấy có sự giảm biểu hiện các protein nephrin, PARD-3 và PARD-6 gây ra sự tiết các tế bào cầu thận có chân qua nước tiểu và chỉ ra rằng việc định lượng các tế bào này trong nước tiểu có thể tiên lượng các trường hợp TSG 50 .
Phương pháp hoá mô miễn dịch lần đầu tiên được ứng dụng để phát hiện sự hiện diện của các tế bào cầu thận có chân trong chẩn đoán biến chứng TSG, được báo cáo bởi Jim B và cộng sự, có độ nhạy và độ đặc hiệu trong chẩn đoán TSG giai đoạn sớm lần lượt là 38% và 70%. Tuy nhiên, nghiên cứu này cũng chỉ ra rằng nên kết hợp với các yếu tố khác như đạm niệu và huyết áp, nếu chỉ dựa vào duy nhất một giá trị của xét nghiệm phát hiện sự hiện diện của các tế bào cầu thận có chân trong nước tiểu thai phụ không đủ ý nghĩa lâm sàng để có thể sử dụng như một công cụ chẩn đoán đặc hiệu TSG giai đoạn sớm 51 . Ở tam cá nguyệt thứ hai, các trường hợp TSG có sự hiện diện của các tế bào cầu thận có chân trong nước tiểu trong khi ở những thai phụ khoẻ mạnh hoặc những thai phụ chỉ tăng huyết áp đơn thuần không tìm thấy dấu hiệu của các tế bào này. Tình trạng tiết các tế bào này vào nước tiểu ở tam cá nguyệt thứ hai có độ nhạy và độ đặc hiệu cao đáng kể để có thể chẩn đoán TSG 52 . Năm 2012, nghiên cứu của Kelder và cộng sự đề xuất sử dụng phương pháp RT-PCR (Reverse Transcriptase Polymerase Chain Reaction) định lượng RNA thông tin (messenger RNA – mRNA) của các protein đặc trưng của tế bào cầu thận có chân như nephrin, VEGF, podocin trong nước tiểu, nhằm phát hiện gián tiếp tình trạng tiết các tế bào này qua nước tiểu ở các thai phụ mắc TSG. Nghiên cứu này chỉ ra rằng phương pháp này có thể giúp phân biệt nhóm thai phụ được chẩn đoán TSG với những thai phụ có tình trạng tăng huyết áp đơn thuần với độ nhạy và độ đặc hiệu cao. Ngoài ra, các dữ liệu từ nghiên cứu này còn khẳng định phương pháp RT-PCR này có thể được áp dụng như công cụ chẩn đoán sớm TSG ở giai đoạn sớm, từ đó, có thể ngăn nguy cơ phát triển các bệnh lý cầu thận thể nặng ở người mẹ cũng như giúp hạn chế nguy cơ tử vong ở cả mẹ và thai nhi 53 .
Với các bằng chứng về vai trò của sFlt-1 trong tiến triển bệnh lý TSG, phân tử này cũng được đề xuất ứng dụng như một dấu ấn sinh học để chẩn đoán TSG, đặc biệt là ở các giai đoạn sớm 54 . Nghiên cứu của Nikuei và cộng sự đã chứng minh tính chính xác của xét nghiệm đánh giá tỉ lệ sFlt-1/PlGF (PlGF: Placental Growth Factor – nhân tố tăng trưởng từ nhau thai) trong phân biệt các thai phụ mắc TSG với những thai phụ có các triệu chứng tương tự 55 . Tỉ lệ sFlt-1/PlGF cao hơn đáng kể ở thai phụ mắc TSG cũng được khẳng định trong một nghiên cứu khác sau đó 56 . Một phân tích gần đây ở Nhật Bản đề xuất giá trị cut-off cho tỉ lệ này trong chẩn đoán TSG là 38 với giá trị tiên lượng khá cao 57 . Bên cạnh đó, một phân tích cho thấy việc ứng dụng xét nghiệm dựa trên tỉ lệ sFlt-1/PlGF giúp tiên lượng sớm TSG trên thai phụ, có thể giúp giảm các nguy cơ ảnh hưởng sức khoẻ cũng như giúp giảm thiểu chi phí điều trị so với các trường hợp phát hiện TSG muộn và phải nhập viện điều trị các biến chứng 58 . Cho đến nay, chỉ có phương pháp xét nghiệm xác định tỉ lệ sFlt-1/PlGF được phát triển thành sản phẩm thương mại hoá dành cho chẩn đoán sớm nguy cơ TSG trên thai phụ.
KẾT LUẬN
TSG là một biến chứng nội khoa thường gặp trong thai kỳ, xảy ra trên khoảng 5% thai phụ sau tuần thai thứ 20. Biến chứng sản khoa này thường được chẩn đoán thông qua các triệu chứng như tăng huyết áp, kết hợp với tình trạng đạm niệu, có thể gây ra các tổn thương nghiêm trọng đến sức khoẻ của thai phụ, thậm chí gây tử vong.
TSG cũng được cho rằng làm tăng các nguy cơ mắc các bệnh lý trên thận như bệnh thận mãn tính hay xơ hoá cầu thận khu trú. Nhiều bằng chứng cho thấy các tế bào cầu thận có chân (podocyte) có vai trò quan trọng trong chức năng lọc của cầu thận và có liên quan mật thiết với biến chứng TSG. Hoạt động sinh tổng hợp protein của các tế bào cầu thận có chân được cho là có mối tương quan với tình trạng đạm niệu ở các thai phụ được chẩn đoán TSG.
Sự hiện diện của các tế bào cầu thận có chân cũng như những protein đặc trưng của chúng như nephrin, podocin, VEGF, …đang được quan tâm nghiên cứu để có thể ứng dụng như dấu ấn sinh học tiềm năng nhằm chẩn đoán sớm nguy cơ TSG. Cho đến nay, nhiều phương pháp sinh học phân tử đang được nghiên cứu ứng dụng cho các xét nghiệm chẩn đoán sớm nguy cơ TSG, có thể kể đến như hoá mô miễn dịch nhằm phát hiện trực tiếp sự hiện diện của các tế bào cầu thận trong nước tiểu, RT-PCR nhằm phát hiện gián tiếp sự hiện diện của các tế bào cầu thận có chân thông qua các phân tử mRNA mã hoá cho các protein đặc trưng cho các tế bào này, hoặc kit định lượng xác định tỉ lệ sFlt-1/PlGF,…Tuy nhiên, kết quả các nghiên cứu vẫn chưa thống nhất nên các xét nghiệm này vẫn chưa được ứng dụng rộng rãi. Trong tương lai, vẫn cần thêm nhiều nghiên cứu nhằm khẳng định giá trị tiên lượng của các xét nghiệm này trong chẩn đoán TSG giai đoạn sớm, nhằm hạn chế các tác động tiêu cực của biến chứng sản khoa này trên cả mẹ và thai nhi.
DANH MỤC TỪ VIẾT TẮT
TSG Tiền sản giật
VEGF Vascular Endothelial Growth Factor (Nhân tố tăng trưởng nội mô mạch máu)
HELLP syndrome Hemolysis, Elevated Liver enzymes and Low Platelets syndrome (Hội chứng tán huyết, tăng men gan, giảm tiểu cầu)
ESRD End-Stage Renal Disease (Bệnh thận mãn tính)
FSGS Focal Segmental Glomerulosclerosis (Bệnh lý xơ hoá cầu thận khu trú)
RT – PCR Reverse Transcriptase Polymerase Chain Reaction (PCR phiên mã ngược)
PEC Perietal Epithelial Cells
CD44 Cluster of Differentiation 44
GBM Glomerular Basement Membrane (Màng đáy cầu thận)
CD2AP CD2 Associated Protein
GLEPP-1 Glomerular Epithelial Protein 1
miRNA micro Ribonucleic Acid
PARD-3 Partitioning Defective 3
PARD-6 Partitioning Defective 6
mRNA messenger Ribonucleic Acid
PlGF Placental Growth Factor (Nhân tố tăng trưởng từ nhau thai)
XUNG ĐỘT LỢI ÍCH
Tác giả cam kết không mâu thuẫn quyền lợi hay xung đột lợi ích liên quan đến bài tổng quan này.
ĐÓNG GÓP CỦA TÁC GIẢ
Tác giả Ngô Ngọc Phương Thuỳ : soạn thảo bài tổng quan
Tác giả Trần Huy Dũng : cố vấn chuyên môn và chịu trách nhiệm nội dung
References
- Fingar KR, Mabry-Hernandez I, Metzger QN, Wolff T, Steiner CA, Elixhauser A. Delivery Hospitalizations Involving Preeclampsia and Eclampsia, 2005 - 2014 2017 [cited 2021 03 - Nov]. . ;:. Google Scholar
- Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Am J Obstet Gynecol. 2000;183(1):S1-S22. . ;:. PubMed Google Scholar
- Maynard SE, Min JY, Merchan J, Lim KH, Li J, Mondal S, et al. Excess placental soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction, hypertension, and proteinuria in preeclampsia. J Clin Invest. 2003;111(5):649-58. . ;:. PubMed Google Scholar
- Maroeska Te Loo D, Bosma N, Van Hinsbergh V, Span P, De Waal R, Clarijs R, et al. Elevated levels of vascular endothelial growth factor in serum of patients with D+ HUS. Pediatr Nephrol. 2004;19(7):754-60. . ;:. PubMed Google Scholar
- Vuorela P, Helske S, Hornig C, Alitalo K, Weich H, Halmesmaki E. Amniotic fluid--soluble vascular endothelial growth factor receptor-1 in preeclampsia. Obstet Gynecol. 2000;95(3):353-7. . ;:. PubMed Google Scholar
- Levine RJ, Maynard SE, Qian C, Lim KH, England LJ, Yu KF, et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med. 2004;350(7):672-83. . ;:. PubMed Google Scholar
- Park CW, Park JS, Shim SS, Jun JK, Yoon BH, Romero R. An elevated maternal plasma, but not amniotic fluid, soluble fms-like tyrosine kinase-1 (sFlt-1) at the time of mid-trimester genetic amniocentesis is a risk factor for preeclampsia. Am J Obstet Gynecol. 2005;193(3 Pt 2):984-9. . ;:. PubMed Google Scholar
- Chaiworapongsa T, Romero R, Espinoza J, Bujold E, Mee Kim Y, Goncalves LF, et al. Evidence supporting a role for blockade of the vascular endothelial growth factor system in the pathophysiology of preeclampsia. Young Investigator Award. Am J Obstet Gynecol. 2004;190(6):1541-7; discussion 7-50. . ;:. PubMed Google Scholar
- Rath W, Faridi A, Dudenhausen JW. HELLP syndrome. J Perinat Med. 2000;28(4):249-60. . ;:. PubMed Google Scholar
- Ihle BU, Long P, Oats J. Early onset pre-eclampsia: recognition of underlying renal disease. Br Med J (Clin Res Ed). 1987;294(6564):79-81. . ;:. PubMed Google Scholar
- Nochy D, Birembaut P, Hinglais N, Freund M, Idatte JM, Jacquot C, et al. Renal lesions in the hypertensive syndromes of pregnancy: immunomorphological and ultrastructural studies in 114 cases. Clin Nephrol. 1980;13(4):155-62. . ;:. Google Scholar
- Lafayette RA, Druzin M, Sibley R, Derby G, Malik T, Huie P, et al. Nature of glomerular dysfunction in pre-eclampsia. Kidney Int. 1998;54(4):1240-9. . ;:. PubMed Google Scholar
- Kristensen K, Larsson I, Hansson SR. Increased cystatin C expression in the pre-eclamptic placenta. Mol Hum Reprod. 2007;13(3):189-95. . ;:. PubMed Google Scholar
- Smith GC, Pell JP, Walsh D. Pregnancy complications and maternal risk of ischaemic heart disease: a retrospective cohort study of 129,290 births. Lancet. 2001;357(9273):2002-6. . ;:. Google Scholar
- Bar J, Kaplan B, Wittenberg C, Erman A, Boner G, Ben-Rafael Z, et al. Microalbuminuria after pregnancy complicated by pre-eclampsia. Nephrol Dial Transplant. 1999;14(5):1129-32. . ;:. PubMed Google Scholar
- Vikse BE, Irgens LM, Leivestad T, Skjaerven R, Iversen BM. Preeclampsia and the risk of end-stage renal disease. N Engl J Med. 2008;359(8):800-9. . ;:. PubMed Google Scholar
- Khashan AS, Evans M, Kublickas M, McCarthy FP, Kenny LC, Stenvinkel P, et al. Preeclampsia and risk of end stage kidney disease: A Swedish nationwide cohort study. PLoS Med. 2019;16(7):e1002875. . ;:. Google Scholar
- Wharram BL, Goyal M, Wiggins JE, Sanden SK, Hussain S, Filipiak WE, et al. Podocyte depletion causes glomerulosclerosis: diphtheria toxin-induced podocyte depletion in rats expressing human diphtheria toxin receptor transgene. J Am Soc Nephrol. 2005;16(10):2941-52. . ;:. PubMed Google Scholar
- Saritas T, Moeller MJ. Glomerular disease: pre-eclampsia, podocyturia and the role of parietal epithelial cells. Nat Rev Nephrol. 2014;10(11):615-6. . ;:. PubMed Google Scholar
- Smeets B, Kuppe C, Sicking EM, Fuss A, Jirak P, van Kuppevelt TH, et al. Parietal epithelial cells participate in the formation of sclerotic lesions in focal segmental glomerulosclerosis. J Am Soc Nephrol. 2011;22(7):1262-74. . ;:. PubMed Google Scholar
- Pabst HW, Klemm J, Haubold U. [Isotope studies on the effect of partial body irradiation on liver circulation]. Nucl Med (Stuttg). 1967:287-91. . ;:. Google Scholar
- Matsusaka T, Sandgren E, Shintani A, Kon V, Pastan I, Fogo AB, et al. Podocyte injury damages other podocytes. J Am Soc Nephrol. 2011;22(7):1275-85. . ;:. PubMed Google Scholar
- Lioufas N, Ling J, Jaw J, Mathew M, Jose M. Does Pre-Eclampsia Predispose Patients to the Development of Focal Segmental Glomerulosclerosis? "The Chicken or the Egg?". J Clin Nephron Ren Care. 2016;2:012. . ;:. Google Scholar
- Reiser J, Altintas MM. Podocytes. F1000Res. 2016;5. . ;:. Google Scholar
- Asanuma K, Shirato I, Ishidoh K, Kominami E, Tomino Y. Selective modulation of the secretion of proteinases and their inhibitors by growth factors in cultured differentiated podocytes. Kidney Int. 2002;62(3):822-31. . ;:. Google Scholar
- Armaly Z, Jadaon JE, Jabbour A, Abassi ZA. Preeclampsia: Novel Mechanisms and Potential Therapeutic Approaches. Front Physiol. 2018;9:973. . ;:. PubMed Google Scholar
- Mundel P, Kriz W. Structure and function of podocytes: an update. Anat Embryol (Berl). 1995;192(5):385-97. . ;:. PubMed Google Scholar
- Garg P, Verma R, Nihalani D, Johnstone DB, Holzman LB. Neph1 cooperates with nephrin to transduce a signal that induces actin polymerization. Mol Cell Biol. 2007;27(24):8698-712. . ;:. PubMed Google Scholar
- Ichimura K, Kurihara H, Sakai T. Actin filament organization of foot processes in rat podocytes. J Histochem Cytochem. 2003;51(12):1589-600. . ;:. PubMed Google Scholar
- Fan Q, Xing Y, Ding J, Guan N, Zhang J. The relationship among nephrin, podocin, CD2AP, and alpha-actinin might not be a true 'interaction' in podocyte. Kidney Int. 2006;69(7):1207-15. . ;:. PubMed Google Scholar
- Eremina V, Sood M, Haigh J, Nagy A, Lajoie G, Ferrara N, et al. Glomerular-specific alterations of VEGF-A expression lead to distinct congenital and acquired renal diseases. J Clin Invest. 2003;111(5):707-16. . ;:. PubMed Google Scholar
- Eremina V, Quaggin SE. The role of VEGF-A in glomerular development and function. Curr Opin Nephrol Hypertens. 2004;13(1):9-15. . ;:. PubMed Google Scholar
- Wagner SJ, Craici IM, Grande JP, Garovic VD. From placenta to podocyte: vascular and podocyte pathophysiology in preeclampsia. Clin Nephrol. 2012;78(3):241-9. . ;:. PubMed Google Scholar
- Shankland SJ. The podocyte's response to injury: role in proteinuria and glomerulosclerosis. Kidney Int. 2006;69(12):2131-47. . ;:. PubMed Google Scholar
- Vogelmann SU, Nelson WJ, Myers BD, Lemley KV. Urinary excretion of viable podocytes in health and renal disease. Am J Physiol Renal Physiol. 2003;285(1):F40-8. . ;:. PubMed Google Scholar
- Kwiatkowska E, Stefanska K, Zielinski M, Sakowska J, Jankowiak M, Trzonkowski P, et al. Podocytes-The Most Vulnerable Renal Cells in Preeclampsia. Int J Mol Sci. 2020;21(14). . ;:. PubMed Google Scholar
- Garovic VD, Wagner SJ, Petrovic LM, Gray CE, Hall P, Sugimoto H, et al. Glomerular expression of nephrin and synaptopodin, but not podocin, is decreased in kidney sections from women with preeclampsia. Nephrol Dial Transplant. 2007;22(4):1136-43. . ;:. PubMed Google Scholar
- Wang Y, Zhao S, Loyd S, Groome LJ. Increased urinary excretion of nephrin, podocalyxin, and betaig-h3 in women with preeclampsia. Am J Physiol Renal Physiol. 2012;302(9):F1084-9. . ;:. PubMed Google Scholar
- Chen G, Zhang L, Jin X, Zhou Y, Niu J, Chen J, et al. Effects of angiogenic factors, antagonists, and podocyte injury on development of proteinuria in preeclampsia. Reprod Sci. 2013;20(5):579-88. . ;:. PubMed Google Scholar
- Henao DE, Arias LF, Mathieson PW, Ni L, Welsh GI, Bueno JC, et al. Preeclamptic sera directly induce slit-diaphragm protein redistribution and alter podocyte barrier-forming capacity. Nephron Exp Nephrol. 2008;110(3):e73-81. . ;:. PubMed Google Scholar
- Collino F, Bussolati B, Gerbaudo E, Marozio L, Pelissetto S, Benedetto C, et al. Preeclamptic sera induce nephrin shedding from podocytes through endothelin-1 release by endothelial glomerular cells. Am J Physiol Renal Physiol. 2008;294(5):F1185-94. . ;:. PubMed Google Scholar
- Zhao S, Gu X, Groome LJ, Wang Y. Decreased nephrin and GLEPP-1, but increased VEGF, Flt-1, and nitrotyrosine, expressions in kidney tissue sections from women with preeclampsia. Reprod Sci. 2009;16(10):970-9. . ;:. PubMed Google Scholar
- Henao DE, Cadavid AP, Saleem MA. Exogenous vascular endothelial growth factor supplementation can restore the podocyte barrier-forming capacity disrupted by sera of preeclamptic women. J Obstet Gynaecol Res. 2013;39(1):46-52. . ;:. PubMed Google Scholar
- O'Brien J, Hayder H, Zayed Y, Peng C. Overview of MicroRNA Biogenesis, Mechanisms of Actions, and Circulation. Front Endocrinol (Lausanne). 2018;9:402. . ;:. PubMed Google Scholar
- Harvey SJ, Jarad G, Cunningham J, Goldberg S, Schermer B, Harfe BD, et al. Podocyte-specific deletion of dicer alters cytoskeletal dynamics and causes glomerular disease. J Am Soc Nephrol. 2008;19(11):2150-8. . ;:. PubMed Google Scholar
- Shi S, Yu L, Chiu C, Sun Y, Chen J, Khitrov G, et al. Podocyte-selective deletion of dicer induces proteinuria and glomerulosclerosis. J Am Soc Nephrol. 2008;19(11):2159-69. . ;:. PubMed Google Scholar
- Garovic VD, Wagner SJ, Turner ST, Rosenthal DW, Watson WJ, Brost BC, et al. Urinary podocyte excretion as a marker for preeclampsia. Am J Obstet Gynecol. 2007;196(4):320 e1-7. . ;:. PubMed Google Scholar
- Aita K, Etoh M, Hamada H, Yokoyama C, Takahashi A, Suzuki T, et al. Acute and transient podocyte loss and proteinuria in preeclampsia. Nephron Clin Pract. 2009;112(2):c65-70. . ;:. PubMed Google Scholar
- Yu D, Petermann A, Kunter U, Rong S, Shankland SJ, Floege J. Urinary podocyte loss is a more specific marker of ongoing glomerular damage than proteinuria. J Am Soc Nephrol. 2005;16(6):1733-41. . ;:. PubMed Google Scholar
- Zhao S, Gu Y, Coates G, Groome LJ, Saleem MA, Mathieson PW, et al. Altered nephrin and podoplanin distribution is associated with disturbed polarity protein PARD-3 and PARD-6 expressions in podocytes from preeclampsia. Reprod Sci. 2011;18(8):772-80. . ;:. PubMed Google Scholar
- Jim B, Jean-Louis P, Qipo A, Garry D, Mian S, Matos T, et al. Podocyturia as a diagnostic marker for preeclampsia amongst high-risk pregnant patients. J Pregnancy. 2012;2012:984630. . ;:. PubMed Google Scholar
- Craici IM, Wagner SJ, Bailey KR, Fitz-Gibbon PD, Wood-Wentz CM, Turner ST, et al. Podocyturia predates proteinuria and clinical features of preeclampsia: longitudinal prospective study. Hypertension. 2013;61(6):1289-96. . ;:. PubMed Google Scholar
- Kelder TP, Penning ME, Uh HW, Cohen D, Bloemenkamp KW, Bruijn JA, et al. Quantitative polymerase chain reaction-based analysis of podocyturia is a feasible diagnostic tool in preeclampsia. Hypertension. 2012;60(6):1538-44. . ;:. PubMed Google Scholar
- Perales A, Delgado JL, de la Calle M, Garcia-Hernandez JA, Escudero AI, Campillos JM, et al. sFlt-1/PlGF for prediction of early-onset pre-eclampsia: STEPS (Study of Early Pre-eclampsia in Spain). Ultrasound Obstet Gynecol. 2017;50(3):373-82. . ;:. PubMed Google Scholar
- Nikuei P, Rajaei M, Roozbeh N, Mohseni F, Poordarvishi F, Azad M, et al. Diagnostic accuracy of sFlt1/PlGF ratio as a marker for preeclampsia. BMC Pregnancy Childbirth. 2020;20(1):80. . ;:. PubMed Google Scholar
- Pant V, Yadav BK, Sharma J. A cross sectional study to assess the sFlt-1:PlGF ratio in pregnant women with and without preeclampsia. BMC Pregnancy Childbirth. 2019;19(1):266. . ;:. PubMed Google Scholar
- Ohkuchi A, Saito S, Yamamoto T, Minakami H, Masuyama H, Kumasawa K, et al. Short-term prediction of preeclampsia using the sFlt-1/PlGF ratio: a subanalysis of pregnant Japanese women from the PROGNOSIS Asia study. Hypertens Res. 2021;44(7):813-21. . ;:. PubMed Google Scholar
- Chantraine F, Van Calsteren K, Devlieger R, Gruson D, Keirsbilck JV, Dubon Garcia A, et al. Enhancing the value of the sFlt-1/PlGF ratio for the prediction of preeclampsia: Cost analysis from the Belgian healthcare payers' perspective. Pregnancy Hypertens. 2021;26:31-7. . ;:. PubMed Google Scholar

 Open Access
Open Access